Vous êtes ici : UVSQ RechercheActualités de la recherche | Innovation
- Partager cette page :
- Version PDF
Des avancées de recherche autour du virus respiratoire syncytial
Ces avancées autour de la multiplication du VRS font l'objet d'une publication dans la revue PLOS Pathogens par une équipe de chercheurs et chercheuses du laboratoire 2I de l'UVSQ.
le 8 juillet 2022
Publié le 8 juillet 2022
Le virus respiratoire syncytial (VRS) est le principal agent de la bronchiolite du nourrisson. Il est à l'origine de plus de 30 millions de cas de bronchiolite chez l'enfant chaque année dans le monde et constitue la deuxième cause de mortalité infantile. Il peut aussi être responsable d'infections sévères chez les sujets âgés ou fragilisés. Il représente ainsi un problème de santé publique majeur. Pourtant, aucun médicament antiviral ou vaccin n'est encore disponible dans le commerce à ce jour. En fait, le développement d'outils thérapeutiques spécifiques reste ralenti par un manque général de connaissances sur plusieurs aspects des processus moléculaires de la réplication du virus.
« Lors de sa multiplication, le RSV produit des nouveaux génomes viraux complexés à des protéines. Ces complexes ribonucléoprotéiques viraux (RNP) protègent le matériel génétique du virus et permettent son expression. Ils constituent le cœur des virus. Les RNPs sont produits dans le cytoplasme des cellules infectés et doivent être transportés jusqu'à la membrane plasmique pour être incorporés dans les nouveaux virions qui iront infecter de nouvelles cibles. Les RNPs étant des objets volumineux, ils ne peuvent pas diffuser dans le cytoplasme et doivent utiliser des systèmes de transport cellulaires. Pour visualiser et quantifier les mouvements des RNP dans des cellules infectées, nous avons conçu et produit un virus génétiquement modifié exprimant une RNP fluorescente. Nous avons ainsi pu établir que les RNPs du VRS sont transportés le long des microtubules (filaments du cytosquelette) en détournant des vésicules cellulaires impliquées dans le recyclage de protéines membranaires. Nos résultats sont un premier pas vers l'identification de nouvelles cibles thérapeutiques. »
Marie-Anne Rameix-Welti.
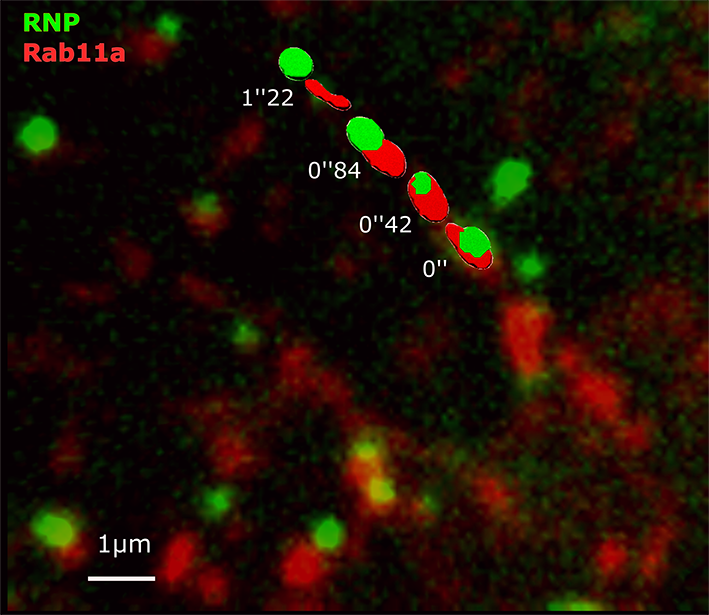 Légende : Dynamique des RNPs et de Rab11. Cellule A549 exprimant transitoirement une protéine rab11 fusionnée à la mCherry (rouge) infectée par un RSV exprimant une RNP fluorescente verte observée sous un microscope confocal. Les positions successives d'une RNP et d'une vésicule Rab11 sont superposée à l'image initiale. La détection des surfaces a été faite dur le logiciel Imaris. Image réalisée par le Dr Gina Cosentino."
Légende : Dynamique des RNPs et de Rab11. Cellule A549 exprimant transitoirement une protéine rab11 fusionnée à la mCherry (rouge) infectée par un RSV exprimant une RNP fluorescente verte observée sous un microscope confocal. Les positions successives d'une RNP et d'une vésicule Rab11 sont superposée à l'image initiale. La détection des surfaces a été faite dur le logiciel Imaris. Image réalisée par le Dr Gina Cosentino."
Marie-Anne Rameix-Welti explique plus en détails qu'au cours des 15 dernières années, la position de la communauté scientifique et médicale internationale sur le virus respiratoire syncytial (VRS) a évolué, considéré auparavant comme un problème limité aux jeunes enfants le VRS apparait aujourd'hui comme un problème de santé publique majeur ayant un impact sur une large population. Le VRS est à l'origine de plus de 30 millions de cas chaque année dans le monde et constitue la deuxième cause de mortalité infantile. Pourtant, aucun médicament antiviral ou vaccin n'est encore disponible dans le commerce. En fait, le développement d'outils thérapeutiques spécifiques reste ralenti par un manque général de connaissances sur plusieurs aspects des processus moléculaires de la réplication du virus.
« Dans ce manuscrit, nous nous sommes concentrés sur un point méconnu de la multiplication du VRS : les mécanismes de transport des ribonucléoprotéines virales (cores viraux) depuis les usines virales jusqu'au site de bourgeonnement. Pour étudier ce processus, nous avons conçu et produit le premier VRS recombinant exprimant une ribonucléoprotéine fluorescente. Nous avons ensuite tiré parti de ce nouvel outil pour visualiser les ribonucléoprotéines virales (vRNP) en mouvement dans des cellules infectées vivantes et analyser automatiquement leurs mouvements. Nous avons ainsi généré des données quantitatives robustes décrivant le comportement des RNPs du RSV. Notre méthode nous a d'abord permis de découvrir que l'exportation des vRNPs du VRS dépend du réseau de microtubules et que les vRNPs sont transportées sur les microtubules en détournant l'endosome de recyclage dépendant de Rab11.
Nos résultats ouvrent la voie à de futures études des mécanismes de transport des RNPs du VRS et à l'identification de nouvelles cibles pour des antiviraux. Nos résultats font écho à la littérature actuelle concernant l'exportation des RNP d'autres virus à ARN négatif tels que les virus de la grippe, des oreillons ou de la rougeole. Bien qu'ils ne soient pas génétiquement liés, ces virus convergent dans leur capacité à détourner la voie du recyclage des endosomes. Notre travail enrichi ainsi la littérature d'un domaine très dynamique et alimentera d'autres recherches axées sur le dialogue entre les virus à ARN et cette voie. »
Glossaire
Ribonucléoprotéine : Génome viral complexé à des protéines. La RNP forme le cœur du virion.
Microtubules : filaments du cytosquelette particulièrement impliqués dans les transports intracellulaires et la division cellulaire.
Endosome : Ce sont des vésicules intracellulaires, il en existe différentes sortes qui assurent les transferts entre et/ou composent les compartiments membranaires comme le golgi, les lysosomes... L'endosome de recyclage est un ensemble de vésicules qui assurent le recyclage de protéines de la membrane plasmique.
« Lors de sa multiplication, le RSV produit des nouveaux génomes viraux complexés à des protéines. Ces complexes ribonucléoprotéiques viraux (RNP) protègent le matériel génétique du virus et permettent son expression. Ils constituent le cœur des virus. Les RNPs sont produits dans le cytoplasme des cellules infectés et doivent être transportés jusqu'à la membrane plasmique pour être incorporés dans les nouveaux virions qui iront infecter de nouvelles cibles. Les RNPs étant des objets volumineux, ils ne peuvent pas diffuser dans le cytoplasme et doivent utiliser des systèmes de transport cellulaires. Pour visualiser et quantifier les mouvements des RNP dans des cellules infectées, nous avons conçu et produit un virus génétiquement modifié exprimant une RNP fluorescente. Nous avons ainsi pu établir que les RNPs du VRS sont transportés le long des microtubules (filaments du cytosquelette) en détournant des vésicules cellulaires impliquées dans le recyclage de protéines membranaires. Nos résultats sont un premier pas vers l'identification de nouvelles cibles thérapeutiques. »
Marie-Anne Rameix-Welti.
 Légende : Dynamique des RNPs et de Rab11. Cellule A549 exprimant transitoirement une protéine rab11 fusionnée à la mCherry (rouge) infectée par un RSV exprimant une RNP fluorescente verte observée sous un microscope confocal. Les positions successives d'une RNP et d'une vésicule Rab11 sont superposée à l'image initiale. La détection des surfaces a été faite dur le logiciel Imaris. Image réalisée par le Dr Gina Cosentino."
Légende : Dynamique des RNPs et de Rab11. Cellule A549 exprimant transitoirement une protéine rab11 fusionnée à la mCherry (rouge) infectée par un RSV exprimant une RNP fluorescente verte observée sous un microscope confocal. Les positions successives d'une RNP et d'une vésicule Rab11 sont superposée à l'image initiale. La détection des surfaces a été faite dur le logiciel Imaris. Image réalisée par le Dr Gina Cosentino."Marie-Anne Rameix-Welti explique plus en détails qu'au cours des 15 dernières années, la position de la communauté scientifique et médicale internationale sur le virus respiratoire syncytial (VRS) a évolué, considéré auparavant comme un problème limité aux jeunes enfants le VRS apparait aujourd'hui comme un problème de santé publique majeur ayant un impact sur une large population. Le VRS est à l'origine de plus de 30 millions de cas chaque année dans le monde et constitue la deuxième cause de mortalité infantile. Pourtant, aucun médicament antiviral ou vaccin n'est encore disponible dans le commerce. En fait, le développement d'outils thérapeutiques spécifiques reste ralenti par un manque général de connaissances sur plusieurs aspects des processus moléculaires de la réplication du virus.
« Dans ce manuscrit, nous nous sommes concentrés sur un point méconnu de la multiplication du VRS : les mécanismes de transport des ribonucléoprotéines virales (cores viraux) depuis les usines virales jusqu'au site de bourgeonnement. Pour étudier ce processus, nous avons conçu et produit le premier VRS recombinant exprimant une ribonucléoprotéine fluorescente. Nous avons ensuite tiré parti de ce nouvel outil pour visualiser les ribonucléoprotéines virales (vRNP) en mouvement dans des cellules infectées vivantes et analyser automatiquement leurs mouvements. Nous avons ainsi généré des données quantitatives robustes décrivant le comportement des RNPs du RSV. Notre méthode nous a d'abord permis de découvrir que l'exportation des vRNPs du VRS dépend du réseau de microtubules et que les vRNPs sont transportées sur les microtubules en détournant l'endosome de recyclage dépendant de Rab11.
Nos résultats ouvrent la voie à de futures études des mécanismes de transport des RNPs du VRS et à l'identification de nouvelles cibles pour des antiviraux. Nos résultats font écho à la littérature actuelle concernant l'exportation des RNP d'autres virus à ARN négatif tels que les virus de la grippe, des oreillons ou de la rougeole. Bien qu'ils ne soient pas génétiquement liés, ces virus convergent dans leur capacité à détourner la voie du recyclage des endosomes. Notre travail enrichi ainsi la littérature d'un domaine très dynamique et alimentera d'autres recherches axées sur le dialogue entre les virus à ARN et cette voie. »
Glossaire
Ribonucléoprotéine : Génome viral complexé à des protéines. La RNP forme le cœur du virion.
Microtubules : filaments du cytosquelette particulièrement impliqués dans les transports intracellulaires et la division cellulaire.
Endosome : Ce sont des vésicules intracellulaires, il en existe différentes sortes qui assurent les transferts entre et/ou composent les compartiments membranaires comme le golgi, les lysosomes... L'endosome de recyclage est un ensemble de vésicules qui assurent le recyclage de protéines de la membrane plasmique.









 Etudiants
Etudiants